快来看看第五年的技术看点榜单中有哪些科学工具将改变今年的科学进程。从基因编辑到蛋白质结构解析,再到量子计算,以下七项技术或在科学界产生重大影响。
许多最初对AlphaFold2将信将疑的实验学家,现在也把它看作是对冷冻电镜这类实验方法的有效补充。
AlphaFold2的计算模型可以帮助数据分析和重建,而冷冻电镜则能发现目前还无法用计算机预测的结构。比如Carragher团队就在使用“时间分辨”(time-resolved)冷冻电镜捕捉蛋白质与其他分子相互作用时的快速构象变化。她说:“我们可以让变化定格,看到100毫秒的时间里究竟发生了什么。
另一种相关技术名为冷冻电子断层扫描(cryo-ET),这种方法可以捕捉到冷冻细胞薄切片中自然发生的蛋白质行为。
但是,这些纷繁复杂的图像解读起来非常难。Carragher认为,机器学习领域在计算能力上的进展将是不可或缺的。她问道:“不然还能如何解决这些几乎无法解决的问题呢 ”3. 量子模拟原子肯定都是原子尺寸的。
但在正确的条件下,原子能处于高度激发态,直径变为1微米或更大。通过对数百个原子精心排列的阵列进行可控激发,物理学家证明了他们可以解决很有挑战的物理学问题,进而超越传统计算机的极限。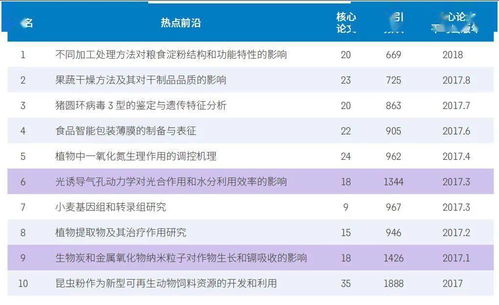
量子计算机以量子比特为单位处理数据。
量子比特通过名为纠缠(entanglement)的量子力学现象耦合在一起,进而在一定距离内相互影响。相对于经典计算机中相同数量的比特,这些量子比特可以显著提高算力。多个团队已经成功利用单个离子作为量子比特,但它们所带的电荷使之难以进行高密度组装。
法国国家科学研究中心(CNRS)的Antoine Browaeys和哈佛大学的Mikhail Lukin等物理学家正在研究另一种方法。他们的团队使用光学镊子将不带电原子精确固定在紧密排列的2D和3D阵列中,然后用激光将这些粒子激发成大直径的里德堡原子(Rydberg atom),使其与附近原子纠缠[10,11]。韩国科学技术院的物理学家Jaewook Ahn解释道,“里德堡原子系统是独立可控的,它们的相互作用可以打开和关闭。”这反过来又赋予了其可编程性。
这种方法在短短几年里就大放异彩,技术进步让里德堡原子阵列的稳定性和性能双双得到提升,量子比特的数量也从几十个迅速扩展到几百个。虽然该技术的早期应用主要集中在已经提出的问题上,如材料性能的预测,但它的用途非常广泛。Browaeys说:“目前为止,理论学家提出的任何理论模型都有其实现方法。”该领域的先锋人士已经成立了公司,目前正在开发供实验室使用的里德堡原子阵列系统,Browaeys预计这种量子模拟器将在一两年内投入商用。
这项工作也为量子计算机的广泛应用铺平了道路,包括在经济学、物流和加密领域的应用。研究人员还无法确定这项创新技术在计算领域中的地位,但Ahn将其比作莱特兄弟在航空领域的早期摸索。他说:“第一架飞机毫无交通优势可言,却改变了整个世界。”4. 精确基因组调控尽管CRISPR-Cas9技术拥有惊人的基因组编辑能力,但它更适用于让基因失活而非基因修复。
这是因为Cas9酶靶向基因组序列虽然还算精准,但细胞对随后双链切割的修复却并不精准。CRISPR-Cas9修复通常由一种称为非同源末端连接(non-homologous end-joining)的过程介导,经常会混入小片段插入或缺失的问题。哈佛大学化学生物学家刘如谦(David Liu)指出,大多数遗传疾病需要的是基因修正而非基因破坏。
刘如谦和他的团队已经为此开发了两种很有前景的方法。这两种方法都利用了CRISPR精准的靶向能力,同时限制了Cas9在该位点切割DNA的能力。第一种方法叫做碱基编辑(base editing),能将催化受损的Cas9与一种酶结合,这种酶能将一种核苷酸转化为另一种——例如将胞嘧啶转化为胸腺嘧啶,或是将腺嘌呤转化为鸟嘌呤(参见Nature
https://
doi.org/hc2t;
2016;CRISPR技术又上一层楼!现在可以编辑DNA单个碱基了)。不过,目前只有特定的碱基-碱基转换可以使用这种方法实现。第二种方法是引导编辑(prime editing),也是该团队最新的研究成果,能将Cas9与逆转录酶联系起来,并使用一种经过修改的向导RNA,这种向导RNA可以将所需的编辑内容整合到基因组序列中(见Nature574, 464–465; 2019;基因编辑研究又下一城:更精准的CRISPR工具面世)。经过一个多阶段的生化过程,这些成分将向导RNA复制到最终取代目标基因组序列的DNA中。重点是,碱基编辑和引导编辑都只剪切一条DNA链,这对细胞来说是一个更安全、破坏性更小的过程。
2016年首次报道的碱基编辑正在走向临床应用:刘如谦在美国坎布里奇市创立的Beam Therapeutics公司在11月获得了美国食品药品监督管理局(FDA)的批准,允许其在人体内首次试验该技术,用于修复导致镰状细胞病的基因。虽然引导编辑的出现时间还不久,但它一直在升级换代,发展前景也很明朗。首尔延世大学医学院的基因组编辑专家Hyongbum Henry Kim和他的团队证明,使用引导编辑修正小鼠的视网膜基因突变,可以达到16%的有效率[12]。
他说:“如果我们使用最新报道的更先进的版本,效率还会得到更大的提升。”刘如谦团队还发现,引导编辑可以帮助将基因尺寸大小的DNA序列插入基因组,有望成为一种更安全、更严格可控的基因疗法[13]。刘如谦说:“虽然这个方法的有效率不算高,但即使是很少的修复,也可以大有裨益。在某些情况下,如果你能以10%甚至1%的有效率替换一个基因,这种病就有救了。
”5. 靶向基因疗法基于核酸的药物可以在临床上产生重大影响,但它们可应用的组织仍有诸多限制。大多数药物要么只能局部给药,要么需要从患者体内提取细胞进行体外处理后,再移植回去。但有一个例外——肝脏。
肝脏可以过滤血液,经证实是选择性药物递送的可靠靶点。这种情况下,静脉注射甚至是皮下注射都可以使用。麻省。
免责声明:本平台仅供信息发布交流之途,请谨慎判断信息真伪。如遇虚假诈骗信息,请立即举报
举报