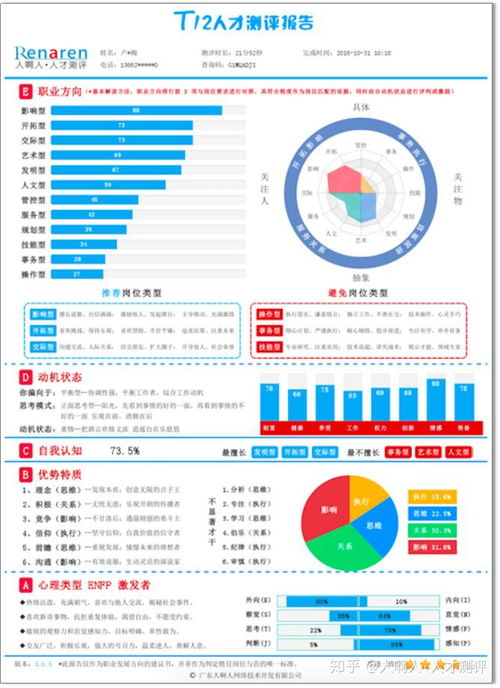
KT-333是一款降解转录调控因子STAT3的潜在“first-in-class”蛋白降解剂,正在开发用于T细胞恶性肿瘤和实体瘤。STAT3 是PTCL的关键调节因子之一,与许多癌症和其他炎症和自身免疫性疾病有关,长期以来被认为是“不可抗药”的靶点,目前没有靶向这一信号通路的疗法获批治疗PTCL。
Kymera Therapeutics是在靶向蛋白降解疗法开发领域的领先生物技术公司之一,于2016年成立,总部位于美国马萨诸塞州剑桥市,虽是新起之秀,但已完成A、B、C轮融资,其专注于用蛋白降解技术治疗癌症和免疫性炎症,布局的靶点有IRAKSTATMDM2等,目前有多款蛋白降解剂获得FDA批准进入临床开发阶段。
靶向蛋白降解技术概况蛋白激酶、离子通道、受体等人体蛋白是当前药物开发最常用的药物靶标。截至 2015 年,美国食品药品监督管理局(FDA)批准的1578种药物分子靶点中 667 种为人源蛋白,占总药物靶点的 75%以上。随着人类基因组成功测序及不断深度解析,构成人类基因组的蛋白质编码基因的实际数目确定为2万多,存在大量潜在药物靶点。
传统靶点确认及干预策略包括使用小分子拮抗剂与靶蛋白特定位点结合来阻断或调节蛋白质功能,然而,细胞内超80%蛋白质如骨架蛋白、转录因子和非酶蛋白等尚未发现有效小分子拮抗剂。
同时,该种“占位驱动(occupancy driven)”作用模式需持续占据靶蛋白活性位点,要求小分子拮抗剂具有高亲和力、长半衰期且一般使用量较大以满足靶点饱和,导致毒副作用大且易产生耐药。基因治疗基本原理在于采用DNA敲除、CRISPR-Cas9及RNA干扰(RNAi)等从DNA和/或mRNA水平上影响基因表达,进而引起细胞总蛋白质水平降低,通常需几小时甚至几天才能形成效果,细胞有足够的时间建立代偿机制或者产生继发效应。另外,翻译前水平间接调控蛋白质表达技术存在调控不可逆性、成药性差、易脱靶等共性问题,仍需进一步完善。
为突破现有药物研发技术的诸多瓶颈,靶向蛋白降解(TPD)技术应运而生,并在近些年获得突飞猛迚的发展,为药物开发提供了新路径,成为极具潜力的新药开发技术之一。泛素-蛋白酶体系统是细胞内80%以上蛋白质降解的主要途径,在DNA修复、信号传导、转录翻译、免疫应答等多种细胞活动中起重要作用。
UPS由泛素(ubiquitin,Ub)、泛素活化酶(ubiquitinactivating enzyme,E1)、泛素缀合酶(ubiquitin-conjugating enzyme,E2)、泛素-蛋白质连接酶(ubiquitin-protein ligase,E3)、蛋白酶体及其底物蛋白等构成。
其中,泛素是一种由76个氨基酸构成的多肽,可在 EEE3三类酶级联反应催化下,特异与底物蛋白形成牢固的共价键进行多聚泛素化修饰,包括KK1K2K29、K3K4K63位的修饰,其中K48多聚泛素修饰蛋白质会被细胞内蛋白酶体识别并进行降解,泛素链被蛋白酶体相关的去泛素化酶(deubiquitinating enzymes,DUBs)去除并循环利用,而蛋白质底物则被折叠和降解。在此基础上,科研工作者开发了deGradFP、PROTAC、 Molecular glue(分子胶水)、dTAG、AID、Trim-Away 等系列蛋白质降解技术。在基于UPS的降解方法中,蛋白水解靶向嵌合体(Proteolysis Targeting Chimeras,PROTACs)是研究最为成熟的系统。
PROTACs的作用机制为“事件驱动”(区别于传统小分子药物的“占据驱动”),与目标蛋白的结合不需要强制占据“结合口袋”,而是结合在靶标上的任何角落或裂隙上都可能潜在地引起降解,理论上可以敲除任何蛋白质,从而使其在靶向不可成药蛋白具有一定优势。作用范围更广,活性更高,可靶向“不可成药”靶点。除此之外,高效能和高选择性也是靶向蛋白降解技术的两大优势,只要PROTACs与靶蛋白是非共价结合,其作用模式就是具有催化性质的,仅需要递送少量的药物,即可使降解持续发生。同时,PROTAC技术在提高活性方面、克服耐药方面也已经显现出了一定优势。
从类型上来看,PROTAC可分为传统的多肽形式 PROTACs、小分子形式 PROTACs;以及包括提高细胞通透性的 CLIPTACs,提高靶向性的光调控 PROTACs,提高灵活性、基于融合标签的PROTACs 等新型PROTAC2.PROTAC药物研发进程随着PROTAC 技术的发展,目前已有SCF、MDMcIAPVHL、CRBN以及共价结合方式的DACF1RNF11RNF4等8种E3复合物被引入到PROTACs药物的研发,涉及靶蛋白有50多种,例如ALK、ER、PI3K、STATCD71等,并被成功用于癌症、神经退行性疾病、自身克疫病等多种疾病的治疗研究中。从研发历程来看,Proteinix公司研究人员于1999 年递交了基于泛素机制使用小分子化合物降解特定蛋白的专利申请,这标志着TPD技术概念的初步形成。2008年基于TPD技术的第一种小分子药物的研究报道则标志着这一新兴药物研发领域冉冉升起,自此TPD技术便开始受到众多学术机构、大型药企以及投资机构的青睐。国际市场方面,Arvinas、C4 Therapeutics、Kymera Therapeutics 、Vividion Therapeutics、Warp DriveBio 和 Cullgen等生物技术公司正在如火如荼地开展蛋白质降解新药的研发,国际大型制药企业如基因泰克、辉瑞、Atlas、诺华、默沙东等也纷纷进军该领域。
国内市场方面,约有20余家企业、高校正在开发PROTAC技术,如凌科制药、成都分迪科技、海创药业等也形成了我国在该领域的第一梯队企业。值得一提的是,海创药业是一家基于氘代技术和PROTAC靶向蛋白降解等技术平台,以开发具有重大临床需求的Best-in-class、First-in-class药物为目标,专注于肿瘤、代谢性疾病等重大治疗领域的创新药物研发。于4月12日正式登陆科创板上市,成为科创板“成都军团”中第五家生物医药企业。而海创药业上市,离不开一批本土金融机构的陪跑,比如盈创资本、成都沛坤、彭州生物、成都高投、四川发展弘科基金等机构。
(更多详细内容请前往药融云医药投融资数据库进行查看)海创药业投融资信息(部分)2019年,首个靶向AR的PROTAC口服小分子ARV-110进入临床试验,标志着PROTAC技术迈出了成药性关键一步,成为该领域的里程碑事件。从全球研发进展来看,目前有十余款药物处于临床阶段,其中ARV-110进展最快,今年2月,Arvinas宣布,在46%肿瘤携带AR T878X/H875Y(T878X=T878A或T878S)突变的患者中,ARV-110 使前列腺特异性抗原(PSA)水平降低≥50%(PSA50),基于这一结果,Arvinas 计划本年底前启动一项关键性临床试验,评估ARV-110治疗mCRPC患者的效果。未来展望虽然目前全球尚无PROTAC药物上市,但随着ARV-1ARV-47KT-474等一系列化合物临床数据的披露,PROTAC药物的有效性和安全性已在临床研究中得到验证。
根据药融云数据,当前已有近20个PAOTAC药物进入临床,探索用于前列腺癌、B细胞淋巴瘤、乳腺癌等疾病的治疗。小分子形式的PROTACs在药物吸收效果上优势较大,但其面临着E3连接酶复合物类型利用率低的主要问题,因此,对各种类型E3复合物的招募、降解机制的充分研究、通过高通量方法筛选可以结合其他种类E3复合物及其结合能力以及特异性更高的小分子化合物将成为小分子形式PROTACs的主要研究方向。综上,TPD技术不仅为新型药物的研发提供了新的思路,也为疾病的治疗提供了新的选择。
在诸多TPD技术中,研究最为成熟的是基于UPS的PROTAC药物,是TPD领域的先头兵。2019年11月26日由中国科学院科技战略咨询研究院等联合发布的《2019 研究前沿》,靶向蛋白降解技术入选生物科学领域Top10热点前沿。虽然TPD技术的发展尚处于起步阶段,目前仍存在诸多缺陷,但凭借其靶标蛋白限制小、特异性高以及作用时间快等多种独有的优势,但相信在不久的将来,必将成为药物研发的主要手段之一,为药物研发领域开创新的纪元,也将给医药产业带来前所未有的机遇。药物的研发是一件极其复杂、费时费力的事情,实时掌握医药行业内发生的大小事,对药物的研发有很大的帮助。
药融云咨询团队联合药学数据分析团队每月将会推出《全球在研新药与靶点月报》,内含一月内医药行业核心数据回顾。本文选题于《药融云6月全球在研新药与靶点月报》,想要获取报告完整内容,关注“药融云”公众号(gh_d20f87bd52d9),回复关键词“报告”即可领取。
免责声明:本平台仅供信息发布交流之途,请谨慎判断信息真伪。如遇虚假诈骗信息,请立即举报
举报